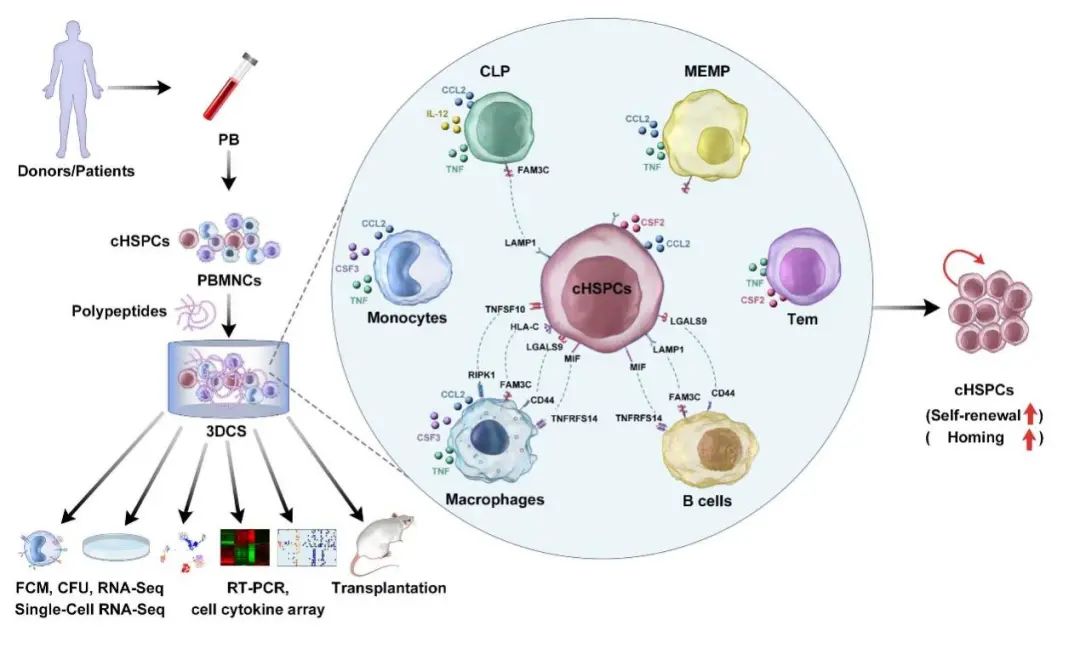
2022年3月1日,威尼斯电子游戏大厅血液与免疫疾病领域首席科学家、威尼斯电子游戏大厅医学院附属第一医院院长黄河教授课题组与威尼斯电子游戏大厅/威尼斯电子游戏大厅基础医学院钱鹏旭研究员课题组在Protein Cell在线合作发表了题为 Efficient expansion of rare human circulating hematopoietic stem/progenitor cells in steady-state blood using a polypeptide-forming 3D culture 的研究论文。
该研究利用自组装多肽RGD水凝胶形成的三维空间,捕获和扩增稳态外周血中稀有循环造血干/祖细胞(cHSPCs)。研究人员利用一系列研究手段探索了扩增的细胞在体外造血克隆形成、体内动物移植潜能以及在群体/单细胞转录组上的分子特征,从多个层次、多个角度阐明了3D系统在捕获和扩增稳态外周血中稀有cHSPCs的作用和机理。
造血干/祖细胞(HSPCs)是一群具有自我更新和多向分化潜能的细胞,能够产生血液系统中的各类造血细胞亚群。目前,造血干细胞移植被广泛应用于治疗白血病、淋巴瘤、多发性骨髓瘤等血液系统恶性疾病,也被用于部分实体瘤以及其他疾病。然而,造血干细胞(HSCs)数量非常稀少,在骨髓单核细胞中,其占比大概为1/50000。目前,HSPCs来源不足是HSPCs临床应用的瓶颈之一。
稳态外周血(PB)中大部分细胞是谱系成熟细胞,由位于骨髓 (BM) 微环境中HSPCs逐级分化而来。由于SDF-1-CXCR4信号通路的刺激,少量HSPCs在外周血和骨髓微环境之间循环,这群在外周血中循环的少量循环造血干祖细胞被定义为循环造血干/祖细胞(cHSPCs)。cHSPCs具有来源广泛、取材方便、侵入式损伤小、病人自身的cHSPCs发生GvHD低等优点,对于解决造血干细胞移植的细胞来源问题具有重要意义。目前,人们对cHSPCs的认识主要来自免疫背景相同的同种动物,对于人类cHSPCs的研究主要集中在cHSPCs与疾病进展的关系等。为了获得足够数量的HSPCs,科学家们探索了一系列方法,包括将多能干细胞诱导分化为HSPC、利用SR1等小分子化合物体外扩增HSPC等。但是cHSPCs频率低、数量少,扩增后获得的造血干祖细胞缺乏长期体内移植功能一直是本研究领域的难点和热点。首先,研究人员对3D系统进行了优化。通过测试和优化不同的细胞因子和小分子化合物组合,研究人员发现自组装多肽RGD水凝胶3D体系联合传统造血生长因子(SCF、TPO、FLT3L、IL-3、IL-6)和VEGF、SR1、Vc组合能显著增加cHSPCs的数量和比例。利用流式细胞术,研究人员检测了cHSPCs各个亚群的比例和数量,以及细胞的增殖情况。结果显示,经过14天的培养,3D体系中CD34+细胞的频率和数量分别增加了125倍和70倍, Ki-67染色证明在3D体系中培养的HSPCs具有较高的增殖能力,克隆形成实验证明在3D体系中培养的HSPCs具有较高的分化潜能。
为了检测3D体系扩增的细胞是否具有体内重建免疫缺陷小鼠造血和免疫系统的潜能,研究人员将3D扩增的细胞经静脉(IV)或经骨髓腔注射的方式(IF)移植到免疫缺陷小鼠体内。结果显示,3D来源的细胞具有与动员骨髓来源的HSPCs (mHSPCs)相似的嵌合率。二次移植实验结果显示,移植小鼠的多个免疫器官包括外周血、骨髓和脾脏中出现人类造血干细胞和免疫细胞。上述结果表明,3D扩增的循环造血干/祖细胞具有体内长期造血重建的潜能。
随后,研究者通过群体/单细胞转录组测序分析,发现3D扩增的外周血循环造血干/祖细胞在转录组水平与骨髓来源的HSPCs相近。T细胞、B细胞等成熟分化的细胞在培养起始时为主要细胞群体,随着培养时间的持续其比例逐渐降低,而HSPCs在培养起始时基本检测不到,在3D培养后期,这些细胞逐渐增多。同时与HSCs自我更新潜能相关的转录因子例如NOTCH1、TAL1、GFI1、HOXB4、CD34、RUNX1、GATA2和HOXA9在HSPCs中富集表达。研究者进一步通过细胞因子芯片等技术分析,发现3D体系中分泌较高的TNF-α,抑制TNF-α水平,cHSPCs的数量和比例显著降低,说明TNF-α在促进cHSPCs扩增中具有重要作用。
最后,研究人员利用3D体系有效扩增了临床上动员失败供者外周血来源的cHSPCs,扩增后的细胞具有重建免疫缺陷小鼠造血和免疫系统潜能,为临床动员失败的外周血造血干/祖细胞提供了一种新的造血干细胞体外扩增体系。
综上所述,该研究开发了一种循环造血干祖细胞的三维培养体系,该体系能高效捕获和扩增稳态外周血中稀有cHSPCs,扩增后的细胞具有重建造血和免疫系统的功能。该方法为造血干/祖细胞临床治疗、药物筛选、疾病建模和基因编辑等提供了一种新的细胞来源,尤其是对于临床造血干细胞动员失败的患者或供者具有一定的临床意义。
https://link.springer.com/article/10.1007/s13238-021-00900-4